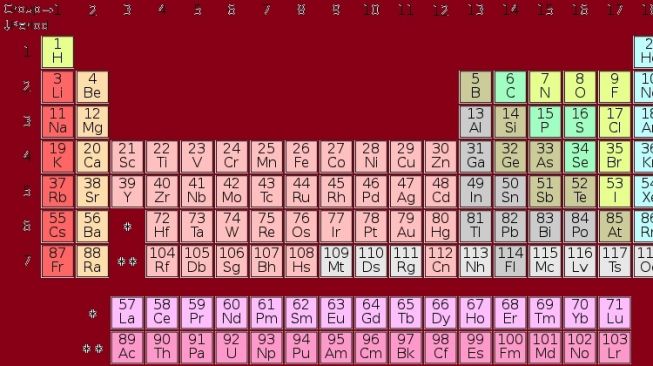
SuaraJogja.id - Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron, dan keberulangan sifat kimia.
Setiap benda-benda di dunia tersusun dari atom-atom yang membentuk unsur. Unsur merupakan zat murni yang tidak dapat diuraikan lagi menjadi zat yang lebih sederhana menggunakan reaksi kimia biasa.
Unsur-unsur tersebut memiliki atom pembentuk dan sifat yang berbeda-beda. Untuk memudahkan kita memahami dan mengelompokkannya, dikenal istilah tabel periodik.
Yuk, simak artikel berikut untuk memahami cara membaca tabel tabel periodik modern ini.
Baca Juga:Hits: Bahan Kimia pada Makanan Cepat Saji, Aktor Will Smith Berpikir untuk Bunuh Diri
Cara Membaca
Tabel periodik modern terdiri dari baris horizontal dan kolom vertikal. Terdapat 7 baris pada tabel ini yang dikelompokkan berdasarkan periode. Artinya, unsur-unsur di baris yang sama mengandung atom-atom dengan bilangan kuantum utama yang sama.
Nomor periode sesuai dengan bilangan kuantum utama (n) tertinggi dari unsur. Periode pertama mengandung 2 unsur, sementara periode selanjutnya terdiri dari 8, 8, 18, 18, 32, dan 32 unsur.
Di periode 6, terdapat 14 unsur yang disebut seri lantanida dan ditempatkan terpisah, yakni di bawah bagian utama tabel periodik. Seri lantanida terdiri dari unsur tanah jarang yang menunjukkan sifat yang mirip. Periode 7 juga memiliki 14 unsur yang dinamakan seri aktinida. Posisinya sama dengan seri lantanida, yakni di bawah bagian utama tabel periodik.
Kolom Vertikal adalah Golongan
Kolom vertikal menunjukkan golongan. Tabel periodik modern memiliki 18 kolom. Artinya, unsur-unsur pada golongan yang sama mengandung atom-atom dengan konfigurasi elektron terluar yang sama. Unsur di golongan yang sama memiliki sifat fisik dan kimia yang serupa.
Misalnya dari paling kiri, kita mendapat golongan IA, yakni logam alkali yang terdiri dari hidrogen, lithium, natrium, dan seterusnya. Unsur-unsur tersebut memiliki 1 elektron valensi yang mudah lepas, sehingga termasuk logam yang paling reaktif dan dapat terbakar di udara.
Baca Juga:Peneliti Temukan Bahan Kimia Berbahaya pada Makanan Cepat Saji
Golongan IIA disebut sebagai logam alkali tanah dan terdiri dari berilium, magnesium, kalsium, dan seterusnya. Unsur-unsur tersebut masuk tergolong reaktif, walaupun kurang jika dibandingkan dengan logam alkali. Unsur-unsur pada golongan IIA dapat larut dalam air, kecuali berilium.
Golongan VIIA yang disebut sebagai halogen terdiri dari fluor, klorin, bromin, dan seterusnya. Unsur-unsur tersebut memiliki 7 elektron valensi dan dikenal sebagai pembentuk garam. Selanjutnya ada golongan VIIIA yang dikenal sebagai gas mulia. Golongan ini tersusun dari helium, neon, argon, dan seterusnya. Mereka disebut gas mulia karena semuanya merupakan unsur yang stabil dan sulit bereaksi dengan unsur lain.
Golongan B yang disebut sebagai unsur transisi. Mereka berada di tengah-tengah sistem periodik dan terdiri dari skandium, titanium, vanadium, hingga seng dan unsur-unsur yang terletak di bawahnya.
Kecenderungan dalam Tabel Periodik
Tabel periodik disusun untuk menampilkan kecenderungan berikut (periodisitas) sebagai berikut:
1. Radius atom atau jari-jari atom (setengah jarak antara pusat dua atom yang saling bersentuhan)
- Meningkat dari atas ke bawah tabel
- Menurun ke kiri ke kanan dari tabel
2. Energi Ionisasi (energi yang dibutuhkan untuk mengeluarkan elektron dari atom)
- Menurun dari atas ke bawah
- Meningkat dari kiri ke kanan
3. Elektronegativitas (ukuran kemampuan untuk membentuk ikatan kimia)
- Menurun dari atas ke bawah
- Meningkat dari kiri ke kanan
4. Afinitas elektron (kemampuan untuk menerima elektron)
Demikian penjelasan terkait tabel periodik. Semoga bermanfaat.
Kontributor : Titi Sabanada